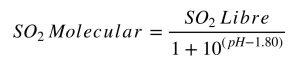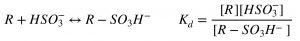El dióxido de azufre, anhídrido sulfuroso o simplemente SO2 es el aditivo más ampliamente utilizado en la industria vitivinícola. Su utilización en la industria alimentaria en general, y vinícola en particular, data de la época romana y ha recibido diferentes cuestionamientos a lo largo de la historia. Si bien la ausencia de SO2 en el vino puede generar diversidad de problemas microbianos y pérdidas de aroma y color, una dosis excesiva puede también provocar alteraciones en el aroma y el sabor del vino e incluso podría llegar a ser perjudicial para la salud del consumidor. Los sulfitos son particularmente peligrosos para aquellas personas intolerantes que carecen de la enzima necesaria para su degradación (sulfito oxidasa), pudiendo provocarles dermatitis, urticaria, dolor abdominal, diarrea y vómitos. También es problemático para las personas que sufren de asma, pudiendo generar complicaciones como broncoconstricción y aumentar la gravedad de los síntomas.
A nivel europeo, la ingesta diaria admisible está fijada en 0,7 mg/kg de peso corporal. Por estos motivos, los niveles máximos admisibles de SO2 están determinados por ley en la mayoría de los países. En el caso de la Unión Europea, el Reglamento Delegado 2019/934 de la Comisión marca los contenidos máximos en SO2 permitidos, como se muestra en la Tabla 1.

Tabla 1. Contenidos máximos de SO2 Total (mg/L) permitidos en la UE.
En el caso de vinos ecológicos, el Reglamento de Ejecución 203/2012 de la Comisión fija que, cuando el contenido de azúcar residual es menor a 2 g/L, los límites son de 100 mg/L SO2 para tintos y 150 mg/L para blancos y rosados. Para el resto de vinos, se debe reducir en 30 mg/L el límite máximo mostrado en la Tabla 1. Los vinos secos biodinámicos certificados por Demeter tienen un límite fijado en 70 mg/L SO2 para tintos y 90 mg/L para blancos y rosados. Para vinos naturales secos, los límites están fijados en 30 mg/L SO2 para tintos y 40 mg/L para blancos y rosados (según la Association des Vins Naturels, de Francia). Por otra parte, la legislación actual de etiquetado de productos vitícolas obliga a declarar la presencia de SO2 cuando las concentraciones son superiores a 10 mg/L en términos de SO2 Total.
La tendencia actual a la reducción de los niveles de SO2 hace que en el mercado se puedan encontrar vinos sin sulfitos añadidos. Sin embargo, esto no implica que no contengan sulfitos en absoluto. De hecho, es muy difícil obtener un vino sin sulfitos. Esto se debe a que la propia levadura responsable de la fermentación alcohólica produce naturalmente SO2 y lo libera al medio. La uva absorbe, a través de la raíz, los sulfatos provenientes del suelo. En ausencia de oxígeno, las levaduras pueden reducir los sulfatos del mosto: en una primera etapa a sulfitos y en una segunda etapa a sulfuros, necesarios para la síntesis de aminoácidos azufrados. En algunos casos, la enzima responsable de reducir los sulfitos se altera, por tanto, éstos se acumulan en el interior de la célula y se acaba liberando SO2 al medio. Por otra parte, finalizada la fermentación y durante el reposo del vino, los sulfuros pueden volver a oxidarse a azufre y finalmente a sulfitos. Algunas levaduras son capaces de producir mayor cantidad de SO2 que otras, por lo que las cepas se clasifican en levaduras de baja y alta producción. Actualmente, la mayoría de las levaduras comerciales pueden denominarse de baja producción, ya que sus niveles de SO2 no superan los 20 mg/L.
Existen diversos compuestos autorizados como aditivos alimentarios (se reconocen por estar descriptos con la letra E seguida de un número) que se utilizan para añadir SO2. Estas sustancias permitidas van desde el E220 a E228, y son: dióxido de azufre (E220), sulfito de sodio (E221), bisulfito de sodio (E222), metabisulfito de sodio (E223), metabisulfito de potasio (E224), sulfito de potasio (E225), sulfito de calcio (E226), bisulfito de calcio (E227) y bisulfito de potasio (E228). A nivel enológico, las prácticas autorizadas permiten únicamente la utilización de dióxido de azufre (E220), metabisulfito de potasio (E224) y bisulfito de potasio (E228). Además, sólo durante la fermentación alcohólica, puede emplearse bisulfito de amonio como activador.
Efectos y propiedades
Tres grandes propiedades que se le atribuyen al SO2 son su poder antioxidante, antioxidásico y antimicrobiano. La acción antioxidante se debe al consumo del oxígeno disuelto y del peróxido de hidrógeno que pudiera estar presente y a la reducción de las quinonas a su forma fenólica. El poder antioxidásico se fundamenta en la capacidad del SO2 de inhibir enzimas como la polifenol oxidasa, principal responsable del pardeamiento en el vino. El efecto antimicrobiano se explica por un bloqueo del complejo enzimático de los microorganismos, pudiendo llevar a la inhibición de su crecimiento o incluso la muerte. En general, se considera que el SO2 es más efectivo contra bacterias que contra levaduras, siendo importante su acción frente a bacterias lácticas y levaduras del género Brettanomyces. El SO2 también presenta poder disgregante por su capacidad de romper la pared celular de la piel de la uva, permitiendo una rápida extracción de los componentes al mosto. Para finalizar, el SO2 tiene cierto poder clarificante debido a la capacidad de destruir los coloides protectores de la uva (pectinas, gomas, mucílagos), facilitando la precipitación de las partículas y evitando la formación de turbidez.
Formas químicas del SO2
Todas las propiedades que se adjudican al SO2, dependen fundamentalmente de la concentración y la forma en que éste se encuentre disuelto en el mosto o vino. No todas las formas del SO2 son igual de activas para llevar a cabo sus funciones. Cuando cualesquiera de los aditivos antes nombrados se agregan al mosto o vino, el SO2 reacciona con el agua formando una variedad de sustancias que van a estar en un complejo equilibrio químico.
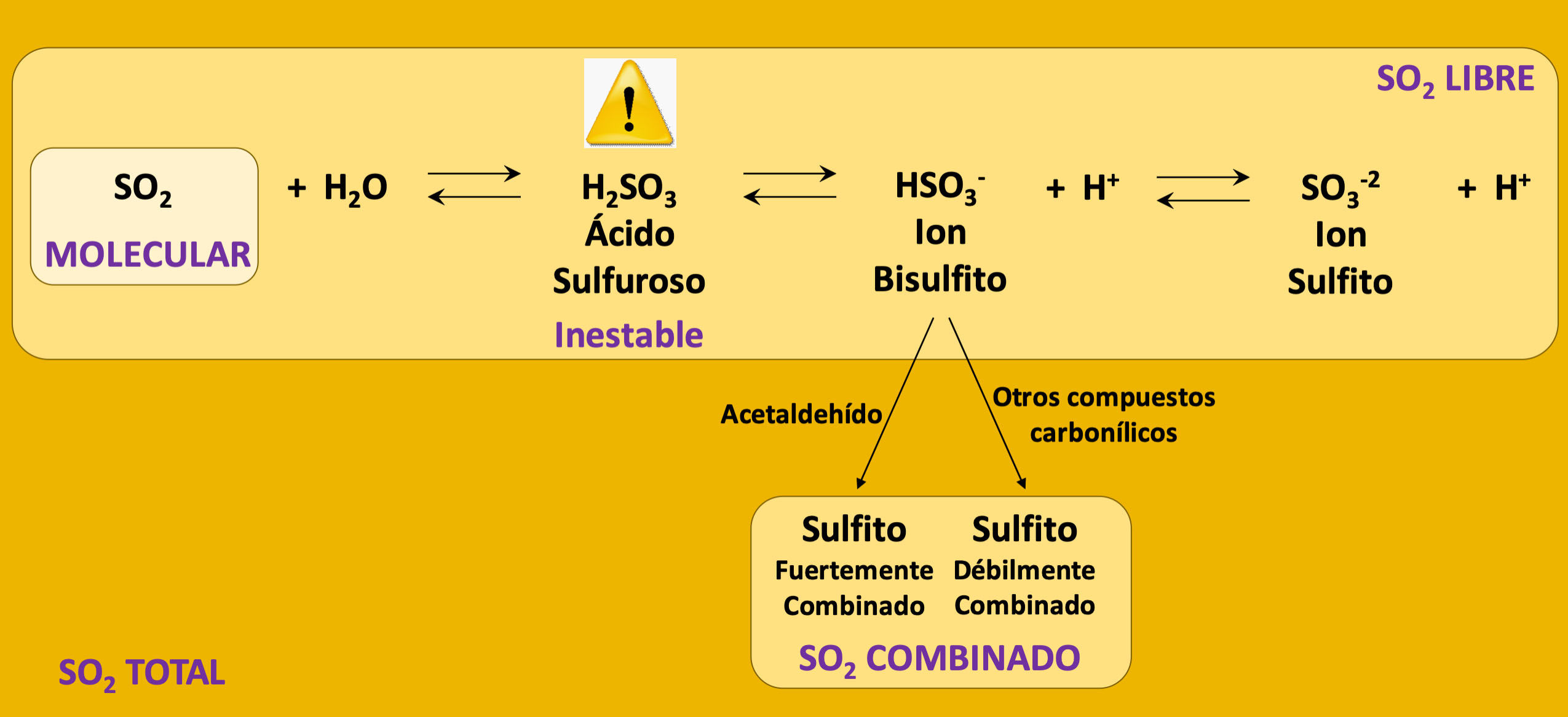
Figura 1. Equilibrio esquemático de las formas químicas del SO2 presentes en el vino.
En la Figura 1, podemos observar en detalle las diferentes formas químicas del SO2. Se pueden entonces distinguir cinco formas para el SO2 en solución: el SO2 Molecular, el ion bisulfito (HSO3-), el ion sulfito (SO3-2) y las formas combinadas del SO2 (el ácido sulfuroso, H2SO3, es demasiado inestable para ser detectado en solución). Las primeras tres formas químicas componen el denominado SO2 Libre, mientras que las dos últimas generan el llamado SO2 Combinado. La suma del SO2 Libre y el combinado da el valor de SO2 Total, que es el parámetro utilizado como referencia en los límites máximos fijados por la legislación.
A estas cinco formas en solución, se le podría agregar el SO2 gaseoso que se encuentra en los espacios de aire de los tanques o en el espacio de cabeza de la botella y que está en equilibrio con el SO2 Molecular. A continuación, describiremos más en detalle cada una de ellas.
SO2 Libre
El SO2 Molecular es el responsable de la acción antiséptica. Se suele considerar que es 20 veces más efectivo que el ion bisulfito en la inhibición de levaduras y 500 veces más en la inhibición de bacterias. Además, posee cierta actividad antioxidante. Por su parte, el ion bisulfito es el principal responsable de la inhibición de la polifenol oxidasa, siendo menor su actividad antioxidante y antimicrobiana. Por último, el ion sulfito es capaz de reaccionar con el oxígeno y el peróxido de hidrógeno disuelto, y por tanto posee cierta capacidad antioxidante. Estas tres formas químicas forman el denominado SO2 Libre, fundamental en el control del vino. La concentración relativa de cada una de las tres formas químicas estará determinada por las constantes químicas de disociación (K1 para el equilibrio entre SO2 Molecular e ion bisulfito y K2 para el equilibrio entre ion bisulfito e ion sulfito) y el valor de pH, por su efecto en la concentración de iones hidrógeno en el medio.

Figura 2. Equilibrio entre las formas químicas del SO Libre en función del pH del medio.
La Figura 2 muestra la evolución de la concentración de las diferentes formas según el valor de pH del medio. Se puede observar que a los valores de pH habituales en vino (entre 3 y 4), la forma bisulfito es prácticamente mayoritaria mientras que la forma sulfito es casi despreciable. Por tanto, el pH no influenciará la función antioxidásica. Por otra parte, la presencia de SO2 Molecular, responsable de la actividad antimicrobiana, es mayor a pH más bajos (más ácidos). A modo de ejemplo, a un pH igual a 3, el SO2 Molecular representa el 5,9% mientras que a un pH igual a 4, sólo representa el 0,6%, unas diez veces menos, quedando por tanto muy limitada su acción antiséptica. Una manera rápida de estimar el SO2 Molecular presente en nuestro vino es utilizar tablas que brindan la concentración del mismo en función del pH y del valor de SO2 Libre. Otra manera es utilizar la siguiente fórmula matemática.
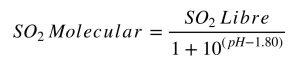
En cuanto al nivel de protección antimicrobiana necesaria, se suelen recomendar niveles de 0,5 mg/L de SO2 Molecular para vinos tintos secos, 0,8 mg/L para vinos blancos secos y 2 mg/L para vinos dulces. Tomando en cuenta estos niveles recomendados, en la Tabla 2 puede observarse el nivel de SO2 Libre necesario en función del pH para llegar a ese nivel de protección.

Tabla 2. Contenido de SO2 Libre (mg/L) necesario para obtener una cierta dosis de SO2 Molecular.
Si tomamos como ejemplo un vino blanco seco con pH de 3,20, se necesitarían 21 mg/L de SO2 Libre para obtener la protección necesaria. Si en cambio fuera un vino tinto seco con un pH ligeramente ácido de 3,50 se necesitarían 26 mg/L de SO2 Libre. Si este mismo vino tinto tuviera un pH más elevado, por ejemplo de 3,80, pasarían a ser necesarios 51 mg/L de SO2 Libre, aproximadamente el doble. Y si, por desgracia, el pH fuera de 4, la dosis requerida de SO2 Libre sería de 80 mg/L. Por tanto, puede verse la fuerte influencia del pH en la dosis necesaria para obtener una efectiva protección antimicrobiana.
Todos los cálculos antes hechos están realizados a una temperatura de 20 °C y en un medio totalmente acuoso. Sin embargo, el vino es una mezcla muy compleja de diversas sustancias (agua, alcohol, azúcares, etc.). Podría elevarse el nivel del análisis químico a un modelo más detallado y completo, teniendo en cuenta la influencia de la temperatura, el grado alcohólico y la fuerza iónica sobre el valor de las constantes de disociación K1 y K2, antes nombradas. Existen ecuaciones, de cierta complejidad, que permiten calcular los valores modificados de las constantes en función de la fuerza iónica, la temperatura y la constante dieléctrica del medio (que depende a su vez de la temperatura, la fuerza iónica y la concentración de las diversas sustancias del medio).

Figura 3. Variación del valor de la pK1 en función de la temperatura y el grado alcohólico.
La Figura 3 muestra una de las gráficas que pueden obtenerse a partir de estos cálculos. La fuerza iónica tiene una correlación negativa con el SO2 Molecular, pero puede considerarse despreciable frente a los efectos de la temperatura y el grado alcohólico. En muchos cálculos, se suele tomar un valor de fuerza iónica constante e igual a 0,038 para todos los vinos y mostos. Por su parte, la temperatura ejerce el mayor efecto: un incremento de la misma eleva el contenido de SO2 Molecular. A modo de ejemplo, un vino de 10° de alcohol y pH igual a 3,30 tendrá un 4% de SO2 Molecular a 20 °C, pero esta proporción se elevará a un 14,3% si la temperatura es de 40 °C. El grado alcohólico por su parte también tiene un efecto positivo en el SO2 Molecular, aunque menor al de la temperatura. Tomando el mismo vino descripto anteriormente a 20°C y pH 3,30, si ahora el nivel de alcohol fuera de 15°, la fracción de SO2 Molecular se elevaría al 4,9%. Existen varias tablas en la normativa OIV-MA-AS323-04C que permiten calcular el nivel de SO2 Molecular, en función del pH del vino, el grado alcohólico, la temperatura y el nivel de SO2 Libre. Como el uso de tablas puede resultar tedioso, existen diversas herramientas online para facilitar el cálculo para adquirir un cierto nivel de protección de SO2 Molecular, en base a los parámetros ya mencionados.
SO2 Combinado
El SO2 Combinado se forma por la combinación química del ion bisulfito con varios compuestos presentes en el mosto o vino. El SO2 Combinado no posee actividad antioxidante y antioxidásica, y su efecto antimicrobiano es casi despreciable. Por tanto, la combinación del SO2 genera una pérdida de beneficios derivados del agregado de cualquiera de los productos autorizados.
Mientras que algunas uniones son muy estables, como la generada con el acetaldehído, otras son relativamente poco estables como las establecidas con azúcares, ácidos cetónicos, ácidos urónicos y antocianos. Si se denomina R al compuesto con el cual el ion bisulfito se une, podemos escribir el equilibrio químico y su correspondiente constante de disociación Kd (notar que es la inversa de la constante de unión).
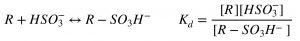
A través de arreglos matemáticos y conversiones entre el valor del peso molecular del ion bisulfito y el del SO2, se puede obtener la siguiente expresión, que relaciona la forma libre (RL) y la forma combinada (RC) del compuesto químico que se une al ion bisulfito con el valor del SO2 Libre en mg/L.

Tomando de ejemplo una dosis de 20 mg/L de SO2 Libre, se analiza el efecto del valor de Kd. Si Kd es igual o menor a 3 x 10-6 M, la relación RC/RL toma un valor de 105, es decir existirá casi 100 veces más compuesto químico R en la forma combinada que en la forma libre. Este tipo de uniones generan el SO2 fuertemente combinado. Por otro lado, si Kd es igual o mayor a 3 x 10-2, la relación RC/RL toma un valor de 1/100, es decir existirá casi 100 veces más compuesto químico R en la forma libre que en la combinada. Este tipo de uniones generan el SO2 débilmente combinado. Cuando parte del SO2 Libre se oxida, este tipo de uniones lábiles se rompen para recomponer el equilibrio químico de todas las especies presentes. Por tanto, se puede considerar el SO2 débilmente combinado como una suerte de reserva de SO2 para mantener la protección antioxidante. El mismo análisis puede hacerse para diferentes concentraciones de SO2 Libre y obtener el SO2 Combinado conociendo la concentración del compuesto combinante R, aprovechando que la suma de RC y RL es igual a la concentración del mismo.
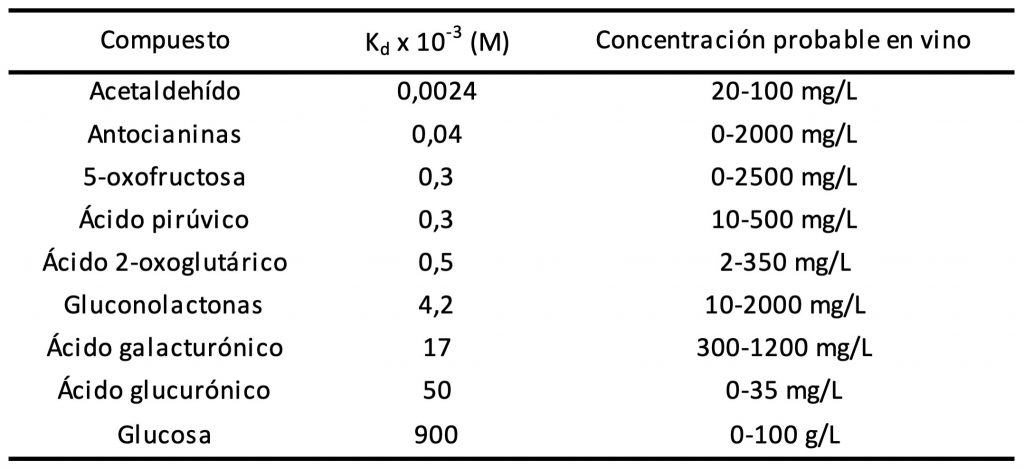
Tabla 3. Valores de Kd y concentraciones medias esperadas para compuestos seleccionados.
Retomando la ecuación de equilibrio químico, se observa que la capacidad de formar compuestos de combinación con el ion bisulfito dependen de la concentración del compuesto y del valor de la Kd. En la Tabla 3 se detallan los valores de Kd para diferentes compuestos presentes en el vino y las concentraciones normalmente encontradas de los mismos. El acetaldehído presenta un valor muy pequeño de Kd, lo cual implica que más del 99% del mismo estará combinado con el ion bisulfito, siendo uno de los principales responsables del SO2 Combinado. Otros compuestos importantes al analizar la combinación del SO2 son el ácido pirúvico y el ácido 2-oxoglutárico, particularmente presentes en mostos botritizados y vinos dulces. Otros compuestos carbonílicos capaces de combinarse con el ion bisulfito son los azúcares (particularmente, glucosa en mostos y vinos dulces), ácidos urónicos (como el glucurónico y el galacturónico), productos de oxidación de los azúcares (por ej., la 5-oxofructosa) y las lactonas del ácido glucónico. También el ion bisulfito puede combinarse con compuestos fenólicos, principalmente antocianinas, generando una reacción reversible de decoloración del mosto o vino.
Considerando los valores de Kd y las concentraciones normales en el vino, se puede llegar a la conclusión que los principales compuestos que participan en la formación del SO2 Combinado son, en orden de importancia, el acetaldehído (51-76%), el ácido pirúvico (10-18%), el ácido 2-oxoglutárico (7-24%) y el ácido galacturónico (2-11%). En vinos dulces, la glucosa pasa a ser también un parámetro a tener en cuenta (1-2%).

Figura 4. Relación entre el contenido de SO2 Libre y SO2 Combinado.
Finalmente, de la ecuación del equilibrio químico, se deriva que el nivel de SO2 Libre también ejerce influencia sobre la cantidad de ion bisulfito que se combina. Un ejemplo de esta influencia se observa en la Figura 4, construida en base al ácido pirúvico a una concentración de 88 mg/L (10-3 mol/L). La imagen representa una típica curva de saturación. Esto implica que para lograr pasar de 0 a 20 mg/L de SO2 Libre, se sacrificarán 33 mg/L de SO2 Combinado. Sin embargo, para pasar de 20 a 40 mg/L de SO2 Libre, sólo se sacrifica un adicional de 10 mg/L de SO2 Combinado. Esto se debe a que cada vez queda menos combinante disponible en forma libre y el principio de la ley de acción de masas limita la reacción química de combinación.
CONCLUSIONES
La utilización del SO2 en enología es una práctica tradicional y ampliamente difundida. Sin embargo, constantemente surgen advertencias sobre su uso, particularmente teniendo en cuenta los efectos adversos sobre la salud humana. Esto ha obligado a una creciente revisión sobre su empleo y la reducción en las dosis empleadas. Se hace fundamental entonces conocer la química que se esconde detrás del SO2 para poder entender los fenómenos que se producen en el vino y así optimizar las cantidades aplicadas.
El objetivo de este trabajo es intentar aportar un poco de claridad, brindando herramientas sencillas para explicar y describir las diferentes formas químicas del SO2 presentes en el mosto y el vino. En base a este conocimiento, y recordando el rol que cada forma química juega en la protección del vino, se puede prever la dosis necesaria para obtener una adecuada acción antimicrobiana, antioxidante y antioxidásica.
La base para aplicar las herramientas disponibles es una correcta determinación del SO2 en el vino, tanto en su forma libre como total. Desde Tecnología Difusión Ibérica, S.L., estamos siempre al servicio del cliente, brindando diferentes soluciones analíticas para la determinación del SO2, desde valoradores manuales y automáticos basados en el método Ripper hasta reactivos colorimétricos adaptados para analizadores automáticos.
Para mayor información puede ponerse en contacto con nosotros. Disponemos de toda una red comercial desplegada por el territorio nacional.