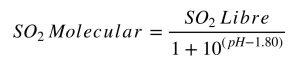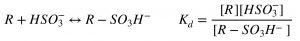Ácido acético y acidez volátil
Similitudes, diferencias y métodos de medición
Dr. Ing. Mario Ignacio Weibel, responsable I+D+i Tecnología Difusión Ibérica S.L.
Introducción
El ácido acético es un ácido orgánico de cadena corta, que presenta un aroma característico a vinagre, producto del cual forma parte en concentraciones relativamente elevadas (4060 g/L). Es solo uno de los varios ácidos que forman parte de la composición química del vino: a la suma de todos ellos se la conoce como acidez total, parámetro fundamental para saber si un vino tendrá suficiente cuerpo, si estará equilibrado y si podrá ser sometido a procesos de crianza. La acidez total es, a su vez, la suma de otros dos tipos de acidez: la fija y la volátil. La acidez fija es, de manera resumida, la suma de todos aquellos ácidos que, cuando el vino es sometido a calor, no se evaporarán. A este grupo pertenecen los ácidos tartárico, málico, láctico y cítrico. Su presencia se nota de forma característica a través del paladar. Por otra parte, la acidez volátil es aquella que se desprenderá del vino al calentarlo. A este apartado pertenecen los ácidos acético, propiónico y butírico, entre otros. El ácido sórbico, el dióxido de carbono y el dióxido de azufre también son volátiles, pero no deben tenerse en cuenta durante la determinación de la acidez volátil. A diferencia de la acidez fija, la acidez volátil generalmente se nota en forma característica a través de la nariz.

FOTO: Miura Micro.
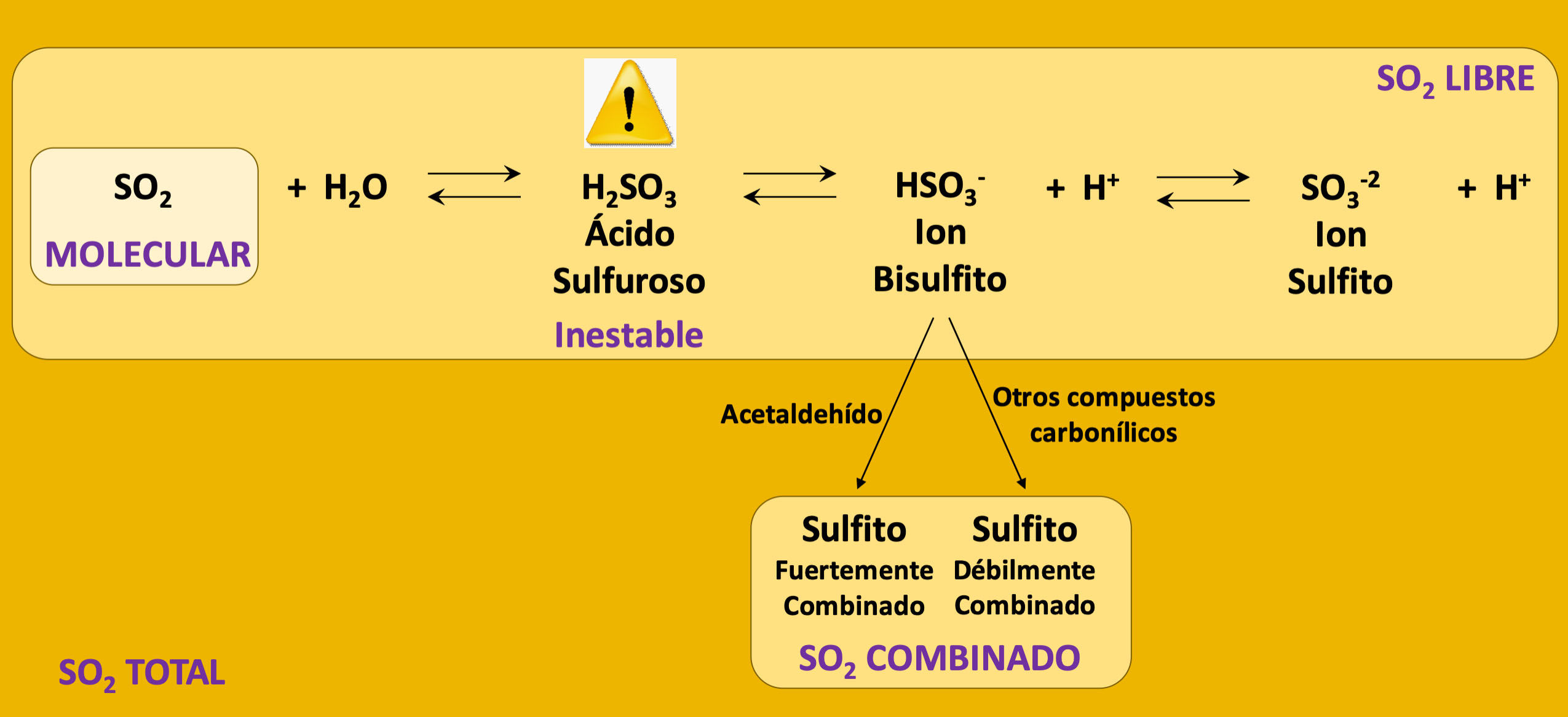
En términos generales, se puede considerar que el ácido acético y sus sales son responsables de entre un 95 al 99% de la acidez volátil. De aquí que usualmente se oiga hablar de ambos parámetros indistintamente, aunque químicamente esto sea erróneo. Por otro lado, cuando se habla de sales del ácido acético, se suele referir más específicamente al acetato de etilo, originado por la esterificación del ácido acético con el etanol presente en el vino, y que tiene una fuerte influencia sobre el aroma.
El contenido normal de ácido acético para un vino ronda los 0,60 g/L, mientras que su presencia comienza a notarse por encima de 0,700,80 g/L. La legislación local de cada país es la que determina los niveles máximos de ácido acético aunque, a modo de referencia, la OIV ha establecido límites de acidez volátil de 1,20 g/L excepto para vinos con condiciones particulares de producción o de crianza. Por otro lado, si bien el acetato de etilo aporta poco a la medida de la acidez volátil (existe 1 parte cada 510 partes de ácido acético), tiene grandes connotaciones en el aroma del vino debido a su bajo umbral de detección (0,08 g/L) y a que en altas cantidades aporta aromas desagradables a pegamento o adhesivos.
Por todo esto, muchos historiadores del vino consideran que la determinación de la acidez volátil y el ácido acético ha sido el primer parámetro de calidad instituido por la industria vinícola. Pero, antes de entrar en los métodos de determinación, será necesario entender cómo llega el ácido acético a ser un componente del vino.
Producción del ácido acético
Por lo general, el ácido acético no suele estar presente en las uvas sanas. Sin embargo, en aquellas bayas “tocadas” sí que pueden existir concentraciones detectables por lo cual puede transformarse en un parámetro indicador de la calidad y estado sanitario de la uva al entrar en bodega. Los racimos que han sufrido rupturas de la piel, bien sea por el granizo o por la acción de aves y/o insectos, pueden verse infectados en la pulpa por diversos hongos y bacterias. Así, en racimos afectados por Botritys, se han detectado poblaciones anormalmente altas de bacterias acéticas como Gluconobacter y Acetobacter, que utilizan el etanol generado como fuente de carbono, oxidándolo a ácido acético.
La mayor parte del ácido acético presente en el vino se produce durante la fermentación alcohólica, siendo sub producto del metabolismo de las levaduras durante la transformación de los azúcares en etanol. En pocas palabras, no es posible fabricar vino sin generar algo de ácido acético. Este proceso es particularmente intenso al inicio de la fermentación y luego, otra vez, sobre el final de la misma. Está comprobado que el ácido acético, junto con el glicerol, son producidos por el metabolismo de Saccharomyces cerevisae para mantener equilibrado el balance redox, como respuesta frente a situaciones de estrés hiperosmótico (debido a altas concentraciones de azúcares). Aunque los niveles de ácido acético generados son normalmente inferiores a 0,400,50 g/L, el contenido exacto puede variar bastante en función de: la cepa de Saccharomyces, la temperatura, el nivel de azúcares, el nivel de nitrógeno disponible, la adición de vitaminas y el pH.
Hay otros mecanismos de producción de ácido acético relacionados con el crecimiento no controlado de determinados microorganismos capaces de producirlo en cantidades considerables. Dentro de ellos, se pueden encontrar bacterias acéticas aerobias del género Acetobacter o Gluconobacter, bacterias lácticas como Oenococcus y poblaciones de levaduras como Picchia, Candida, Kloeckera, Dekkera o Brettanomyces (particularmente en condiciones aerobias). Para poder combatir estos microorganismos es necesario reforzar las tareas de higiene y desinfección en la bodega, además de aplicar protocolos con SO2 y vigilar parámetros fundamentales como pH y temperatura. Además, se ha de tener en cuenta que las bacterias acéticas son aerobias, es decir que para crecer necesitan de la presencia de oxígeno. En estos casos, un correcto manejo de las aportaciones de oxígeno durante el proceso será fundamental para mantener los valores de acético y volátil dentro de los márgenes tolerables. Durante la fermentación alcohólica es sencillo desplazar el oxígeno gracias a la producción de CO2, pero luego debe mantenerse el aporte en los niveles más bajos posibles.
Siguiendo con el proceso de fabricación de un vino, las bacterias lácticas pueden contribuir a subir el nivel de acético en el vino mientras se desarrolla la fermentación maloláctica. Durante la descarboxilación del ácido málico a láctico, las bacterias lácticas heterofermentativas como Oenococcus oeni o Lactobacillus plantarum pueden producir ligeras cantidades de acético en el orden de 0,050,30 g/L, a partir de pequeñas cantidades residuales de glucosa. Los niveles finales dependerán del uso de bacterias comerciales o nativas y de la competencia entre estos microrganismos.
Finalmente, en el período de almacenamiento del vino, este tampoco estará a salvo de sufrir aumentos en la concentración de ácido acético. Cualquier población de bacterias acéticas que haya podido sobrevivir a la fermentación alcohólica y maloláctica puede encontrar las condiciones necesarias para crecer y generar ácido acético a partir de la oxidación del etanol. En estos casos será necesario reducir al máximo los aportes de oxígeno que puedan venir de las diferentes operaciones de trasvase, clarificación, trasiegos, crianza en barrica, filtración y embotella do. Será importante, por tanto, reducir las maniobras con el vino, evitar la utilización de tanques de almacenamiento y barricas que presenten aire en los espacios de cabeza, utilizar gases inertes para desplazar el oxígeno siempre que sea necesario y tener un embotellamiento eficiente que reduzca el aporte de oxígeno.
¿Cuándo y cómo medir el ácido acético?
Como se ha visto, los niveles de ácido acético pueden dispararse en cualquier momento del proceso de producción. Por lo tanto, es aconsejable medir este parámetro al menos en los siguientes casos:
• Después de la fermentación alcohólica.
• Después de la fermentación maloláctica.
• Durante las paradas de fermentación.
• En forma periódica, durante el almacenamiento del vino.
• Cuando los tanques no están llenos completamente.
• Cuando se observa la presencia de un biofilm (de bacterias o levaduras).
• Antes del embotellado.
Conviene llevar un registro de todos estos valores, para poder detectar y solucionar un problema de forma rápida y eficaz.
En el momento de llevar a cabo la determinación, los laboratorios más tradicionales se suelen decantar por medir la acidez volátil, mientras que en los más modernos se ha impuesto la medición de la concentración de ácido acético.
Medición de la acidez volátil
Para medir la acidez volátil, se suelen utilizar destiladores de vidrio donde el calentamiento se efectúa de manera indirecta usando vapor de agua. Para llevar a cabo correctamente la medida es necesario, en primer lugar, quitar el dióxido de carbono de la muestra. También se deberá determinar de manera separada la contribución a la acidez del dióxido de azufre libre y combinado que pudiera destilarse junto con los ácidos volátiles, del ácido sórbico presente (si se hubiera agregado al vino durante el proceso de fabricación) y del ácido salicílico (si se utilizó como conservante de la muestra de vino). En cuanto al agua para generar el vapor, se debe tener cuidado que sea destilada y libre de dióxido de carbono. Respecto al equipo para destilar la muestra, consta básicamente de un generador de vapor, un balón para la muestra, una columna de destilación y un condensador. No cualquier equipo puede ser utilizado, según la OIV éste debe pasar por 3 tipos de test perfectamente detallados en la normativa (OIVMAAS31302) para asegurar que:
• El vapor de agua esté libre de dióxido de carbono, para lo cual se procede a destilar una muestra de agua hervida.
• Se recupera al menos el 99,5% del ácido acético, para esto se destila una muestra de solución de ácido acético 0,1M.
• No más de un 0,5% del ácido láctico es destilado en la muestra, para lo cual se lleva a cabo una destilación de una muestra de solución de ácido láctico 1M.
De acuerdo a la normativa OIV, se debe utilizar un volumen de muestra de 20 mL de vino acidificado con 0,50 g de ácido tartárico, debiendo recuperarse unos 250 mL de destilado (aproximadamente 6 minutos). Este destilado debe ser luego valorado utilizando una solución de hidróxido de sodio (0,1 M) y fenolftaleína como indicador.
Este tipo de métodos suelen ser tediosos y lentos, y pueden tener varias fuentes de error debido a fugas en las uniones, pérdidas de muestra y otros errores operativos. Sin embargo, en muchos países, está adoptado como método oficial y además está muy extendido en bodegas.

FOTO: Destilador DE 2000.

FOTO: Refrigerador de agua DE-Cooler.
Una solución rápida y automatizada para este tipo de análisis sería utilizar un destilador automático como el DE2000 comercializado por TDI, de máxima fiabilidad. Además, para aquellos usuarios preocupados por el consumo de agua necesaria para la refrigeración, existe la posibilidad de agregar una unidad de refrigeración de circuito cerrado como el DECooler, ofrecido también por TDI, que permite operaciones de trabajo más respetuosas y sostenibles con el medio ambiente.
Medición del ácido acético
La irrupción de los analizadores automáticos ha modificado la forma de controlar la calidad de un vino. La tecnología disponible hoy en día permite analizar varios parámetros sobre un gran número de muestras en muy poco tiempo.

FOTO: Analizador Miura One.

FOTO: Analizador químico Miura 200.

FOTO: Analizador químico Miura 200 2 brazos.
A modo de ejemplo, la gama de analizadores Miura de TDI proporciona soluciones de análisis que van desde las 60 hasta las 220 determinaciones por hora, aumentando la eficiencia y reduciendo costes en el laboratorio. Después de muchos años, la determinación de ácido acético en muestras de vino comienza a ser observada como el método más económico y fiable de poder controlar la evolución del vino, incluso siendo avalada por distintas organizaciones.
El método de medición se basa en la acción de un grupo de enzimas que, de forma selectiva y muy específica, reaccionan con el ácido acético generando un cambio en la absorbancia a 340 nm, el cual es fácil de monitorizar a través de un detector. Con la ayuda de una calibración previa con patrones de concentración conocida, es posible determinar rápidamente la concentración de ácido acético en una muestra de vino incógnita.
En el inicio del desarrollo de estas técnicas, los kits enzimáticos para la determinación de ácido acético estaban com puestos por un gran número de enzimas y cofactores liofilizados que debían resuspenderse en tampones y que tenían una estabilidad relativamente baja. Todo esto hacía el análisis enzimático poco práctico y tedioso. Gracias a la inversión en I+D realizada por TDI desde sus inicios, hoy en día estos kits se presentan en formato líquido, con una alta durabilidad y con reactivos de trabajo sencillos de preparar y con estabilidad ampliamente mejorada. Estas prestaciones, sumadas a la existencia de patrones multiparamétricos estables y a la disponibilidad de muestras vínicas de referencia forman una combinación indispensable para asegurar y mantener la calidad de las mediciones. Es por estas razones por las que el kit de Ácido Acético de TDI es año tras año el top de ventas y el parámetro más evaluado en todas aquellas bodegas que confían en nuestros productos.
TDI se caracteriza por proveer la mejor solución analítica, a la medida de cada bodega y laboratorio enológico, y el mejor servicio y atención al cliente. Si tiene alguna necesidad analítica y desea saber cómo resolverla, comuníquese con nosotros vía email (info@t-d-i.es), redes sociales o a la web www.tdianalizadores.com y juntos podremos encontrar la mejor solución.
Más de 35 años de experiencia enológica nos avalan, no lo dude y ¡súmese a la enolución!